Глава 4 Викиди парникових газів в результаті хімічних промислових процесів на оцінка їх емісій
СО2
СО2 являє собою безбарвний газ, який має злегка кислуватий запах та смак. При температурі 20оС і тиску 58,5 атм він згущується в безбарвну рідину. СО2 використовується в хімічній промисловості для виробництва гідрокарбонатів та карбонатів натрію, калію, амонію, вапна, при отриманні оксиду алюмінію, карбаміда, різних вуглекислих солей і т.д. В харчовій промисловості СО2 використовують в виробництві цукру, мінеральних вод, газованих напоїв, в пивоварінні, холодильних установках і т.п.
Сировиною для виробництва вапна та оксиду вуглецю є вапняки , крейда та мармур - породи вуглекислого кальцію різного хімічного складу та фізичних властивостей. Вміст СО2 у вапняках складає 40-50%.
Діоксид вуглецю в невеликих концентраціях (10-15%) утворюється при спаленні твердого палива або при його газифікації. В великих кількостях діоксид вуглецю утворюється при виробництві цементу, вапна, карбаміду і т.д.
Концентрований СО2 (до 40%) утворюється при випалі вапняку. Крім того, значна кількість концентрованого оксиду вуглецю утворюється як побічний продукт при виробництві водню окисленням СО водяним паром, в виробництві етилового спирту, аміаку, чавуну та сталі і т.п.
Оцінка емісій всіх газів всіх виробництв визначається за формулою:
Еij= Aj • Kij
Де Еij - пов’язані з технологічним процесом емісії (в тонах) газу i в промисловому секторі j ;
Aj - об’єм діяльності або випуску продукції в промисловому секторі j (тонн/год);
Kij - коефіціент емісії газу i на одиницю діяльності в промисловому секторі j (тонн/тонн).
ВИРОБНИЦТВО СОДИ
Діоксид вуглецю виділяється при використанні соди і в залежності від процесу може виділятися під час її виробництва.
Емісії СО2 при виробництві соди суттєво залежать від виробничого процесу. Для промислового виробництва соди можуть використовуваться 4 різних процеса. Три з них: моногідратний, сесквикарбонатний (sesquicarbonate) і процес безпосередньої карбонізації є природніми процесами. Четвертий - Солвей (Solvey) процес класифікується як штучний.
Під час виробничого процесу трона (випарений розчин лужніх мінеральних вод, в якому у великій кількості міститься кам'яна сіль NaCl) кальцинується в роторній печі і хімічно трансформується в неочищену соду. В якості супутніх продуктів цього процесу виділяються діоксид вуглецю та вода.
Найбільше значення в промисловості має кальцинована сода - Na2CO3. Вона є основним матеріалом для виготовлення інших содових продуктів: NaHCO3, Na2CO3 ∙ 10H2O, Na2CO3 ∙ H2O, NaOH. Також кальцинована сода широко застосовується у виробництві багатьох інших хімічних продуктів, а також в нафтовій, металургійній, текстильній, шкіряній, паперовій, харчовій та інших галузях промисловості.
Найбільш широко застосовується метод отримання соди за аміачним способом. Суть методу заключається в послідовній обробці розчину повареної солі NaCl аміаком та СО2, в результаті чого утворюється сіль гідрокарбонат натрію NaHCO3 і далі прожарюванням цієї солі отримують кальциновану соду Na2CO3.
Прожарювання вапняку (CaCO3) для отримання вапна (CaO) і оксиду вуглецю та утворення вапняного молока гасінням вапна є підготовчими операціями виробництва соди аміачним способом.
Хімічні реакції, які проходять при утворенні соди за аміачним способом можна представити таким чином:
NaCl + NH3 + CO2 + H2O =30ºC =NaHCO3 + NH4Cl I
2NaHCO3 =обжиг = Na2CO3 + CO2 + H2O II
Перша реакція при температурі 70оС і вище іде в зворотньому напрямку. Друга реакція іде зліва направо лише при високій температурі.
Діоксид вуглецю, який потрібен для першої реакції отримують обжигом вапняку (известняка) або крейди в безперервно діючих вапняно-прожарювальних печах. При цьому відбувається така реакція
CaCO3 = CaO + CO2
Діоксид вуглецю частково регенерується при прожарюванні NaHCO3. Вапно, яке отримують разом з вуглекислим газом, перетворюється на вапняне молоко при дії на нього надлишку води
CaO + H2O = Ca(OH)2,
яке служить для регенерації аміаку із розчину NH4Cl:
2 NH4Cl + Ca(OH)2 = 2 NH3 + CaCl2 + 2 H2O
Регенерований аміак повертається у виробництво. Таким чином, вихідною сировиною для виробництва соди за аміачним способом служать природні або штучні розчини харчової солі, вапняк і крейда.
ОЦІНКА ЕМІСІЙ СО2 ПРИ ВИРОБНИЦТВІ ТА ВИКОРИСТАННІ СОДИ
Для оцінки емісій СО2 при виробництві соди (природний процес) необхідно кількість використаної трони в тоннах помножити на коефіціент емісії, який дорівнює 0,097 тонн СО2 на тонну трони.
Отримане значення емісії СО2 в тоннах можна перевести в гігаграми, якщо поділити його на 103.
Е = А • k,
де Е - емісія діоксиду вуглецю в тоннах,
А - кількість використанної трони в тоннах,
к - коефіціент емісії.
Для оцінки емісій СО2 при використанні соди необхідно кількість використаної соди в тоннах помножити на коефіціент емісії, який дорівнює 415 кілограм СО2 на тонну соди.
Отримане значення емісії СО2 в кілограмах можна перевести в гігаграми, якщо поділити його на 106.
Формула для розрахунків:
Е = А • k,
де Е - емісія двоокису вуглецю в кг,
А - кількість використанної соди,
к - коефіціент емісії.
ВИРОБНИЦТВО ЦЕМЕНТУ ТА ВАПНА
Діоксид вуглецю утворюється при виробництві клінкеру, який є проміжним продуктом виробництва цементу. Виробництво цементу і вапна включає в себе добування сировини, її подрібнення і просіювання, декарбонізацію (наприклад, прожарювання при високих температурах - біля 1100оС), гідратацію вапна до гідроксиду кальцію і далі послідовні дії по перевозці, зберіганню та використанню. Цемент і вапно широко використовуються в будівництві.
Подрібнений вапняк подається в піч, де при температурі 1000-1300оС розкладається (утворюється клінкер):
CaCO3 = CaO + CO2 - 178 кДж
Негашене вапно (клінкер) безперервно надходить на гашення водою:
CaO + H2O = Ca(OH)2 + 21,6 кДж
При взаємодії з водою утворюється гідратне вапно (гашене вапно), яке далі з водою утворює "вапняне молоко". Вапняне молоко, змішане з піском, подрібненим шлаком та іншими матеріалами, застосовують у вигляді будівельних розчинів при кладці стін, різних споруд і для штукатурки.
Процес тверднення вапняного розчину полягає в тому, що надлишкова вода випаровується, а Ca(OH)2 реагує з CO2, який є в повітрі:
Ca(OH)2 + СО2 = CaCO3 + Н2О
Міжнародні данні по виробництву цементу та вапна знаходяться в публікаціях Організації Об’єднаних Націй (1988).
ОЦІНКА ЕМІСІЙ СО2 ПРИ ВИРОБНИЦТВІ ЦЕМЕНТУ ТА ВАПНА
Оцінка емісій вуглекислого газу при виробництві цемента або вапна основана на застосуванні коефіціента емісії, який виражений в тонах СО2 на тонну виробленого вапна на рік.
Таблиця 6
Загальні відомості про коефіціенти емісії СО2 при виробництві цементу
|
Процес |
Газ |
Коефіціент емісії |
|
Печі для вапна - кальцитова сировина |
СО2 |
0,79 тонн СО2 /тонну виробленної швидкогасячого вапна |
|
Печі для вапна - доломітова сировина |
СО2 |
0,91 тонн СО2 / тонну виробленого доломітового вапна |
Для оцінки емісій СО2 при виробництві цементу кількість отриманого цементу в тоннах множать на коефіціент емісії 0,4985 тонн СО2 на тонну виробленного цементу.
Для оцінки емісій СО2 кількість отриманого цементу ( або іншої продукції) в тоннах множать на відповідний коефіціент з таблиці 6 ( для цементу) - в тоннах СО2 на тонну виробленної швидкогасячого або доломітового вапна.
Отриману величину емісії СО2 в тоннах СО2 можна перевести в гігаграми СО2 , якщо поділити отримане значення на 103.
ОЦІНКА ЕМІСІЙ ПРИ ВИКОРИСТАННІ ВАПНА
Оцінка емісій вуглекислого газу, пов’язаних з використанням вапняку, основана на використанні коефеціента емісії СО2 ( в кілограмах СО2 на тонну вапняку на рік).
Для оцінки емісій СО2 кількість використаного вапняку та доломіту в тоннах необхідно помножити на коефіціент емісій, який дорівнює 440 кг СО2 на тонну вапняку.
Для розрахунку емісій СО2 , пов’язаних з використанням доломіта, множимо на коефіціент емісій, який дорівнює 477 кг СО2 на тонну доломіта.
Отриману величину емісії СО2 в кілограмах СО2 можна перевести в гігаграми СО2, якщо поділити отримане значення на 106.
ВИРОБНИЦТВО АМІАКУ
Зв’язування атмосферного азоту в аміак проходить за рівнянням
N2 + 3H2 = 2NH3 + 2Q,
де Q - тепловий ефект реакції.
Реакція синтезу аміаку з газоподібних азоту та водню проходить лише в присутності каталізатора. Як каталізатори, використовують залізо, платину, осмій, марганець, вольфрам, уран, родій та інші метали. Один з найкращих каталізаторів - залізо з добавками невеликих кількостей окислів алюмінію та калію.
Першою стадією процесу синтеза аміаку є стиснення азотоводневої суміші до тиску при якому іде синтез аміаку - 100 - 1000 атм.
Другою стадією є додаткова очистка азотоводневої суміші від ядів: оксиду вуглецю СО, кисню та водневих парів. При очистці шляхом гідрирування проходять реакції:
CO + 3H2 = CH4 + H2O,
O2 + 2H2 = 2H2O.
Cтиснута та очищена азотноводнева суміш далі разом з циркуляційним газом іде в колони для синтезу аміаку.
Процес синтезу протікає при високому тиску (750-1000 атм), середньому тиску (200-300 атм) або низькому тиску (100 атм). Температура синтезу дорівнює 500оС - 550оС.
Зараз існують і більш сучасні способи виробництва аміаку. Аміак виробляється шляхом каталітичного випаровування з природного газу (головним чином з СН4) або з інших видів палива, наприклад, нафти. При виробництві аміаку водень виділяється хімічним шляхом і з’єднується з азотом. Залишковий вуглець виділяється як СО2.
Під час виробництва аміаку можуть виникати емісії NOx, неметанових органічних сполук,CO та SO2.
ОЦІНКА ЕМІСІЙ СО2 ПРИ ВИРОБНИЦТВІ АМІАКУ
Емісії СО2 будуть залежати від кількості та складу газу (нафти), які використовуються в процесі. Передбачається, що весь вуглець буде викидатися в атмосферу.
Найбільш точний метод визначення емісії - за споживанням газу. Вміст вуглецю в природному газі може змінюватися. Бажано це визначати окремо для кожного підприємства. Якщо споживання газу невідомо, то в якості альтернативи проводиться розрахунок по виробництву аміаку. Типовий коефіціент емісії - 1,5 т СО2 на тонну виробленого аміаку не рахуючи газу, який використовувався як паливо.
СО2, який утворюється при виробництві аміаку, може бути використаний для виробництва сечовини та сухого льоду.
Для оцінки емісій СО2 при виробництві аміаку можна використовувати два способи. Перший спосіб оснований на споживанні газу. В цьому випадку для оцінки емісій СО2 в кг кількість використаного газу (водню)(в м3) множать на вміст вуглецю в газі (в кг вуглецю на м3 газу) і на коефіціент співвідношення молекулярних мас СО2 та вуглецю - 44/12. Щоб перевести величину емісій СО2 в гігаграми необхідно поділити получене значення на 106.
Другий спосіб оснований на використанні аміаку. Для оцінки емісій СО2 необхідно кількість виробленого аміаку в тоннах помножити на коефіціент емісії 1,5 т СО2/ т виробленого NH3. Розраховане значення буде в тоннах СО2. Щоб перевести це значення в гігаграми необхідно це значення поділити на 106.
ВИРОБНИЦТВО АЗОТНОЇ КИСЛОТИ
Азотну кислоту виробляють двох типів: слабку (розведену), яка являє собою 50-60% водний розчин, та концентровану, яка містить 96-98% HNO3. Розведена азотна кислота використовується переважно на місці її отримання для виробництва азотнокислих солей, різних мінеральних добрив; концентрована кислота застосовується для нітрування при виробництві барвників, вибухових речовин і т.п.
Процес виробництва розведеної азотної кислоти протікає в дві стадії. В першій стадії аміак окислюється в оксид азоту NO:
4NH3 + 5O2 = 4NO + 6H2O
Друга стадія включає дві основні реакції - окислення оксиду азоту:
2NO + O2 = 2NO2
та взаємодію утвореного діоксиду азоту з водою:
3NO2 + H2O = 2HNO3 + NO
Утворений за цією реакцією оксид азоту знову окислюють і продовжують процес до досягнення певного ступеня перетворення оксиду азота в азотну кислоту.
Концентровану азотну кислоту отримують перегонкою суміші розведеної азотної кислоти з купоросною олією. В останні роки все більше використовують новий метод "прямого " синтезу концентрованої азотної кислоти з діоксиду азоту, кисню та води під тиском біля 50 атм.
При взаємодії аміаку з киснем утворюються в залежності від умов різні продукти окислення:
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 4O2 = 2N2O + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
У відсутності каталізаторів аміак окислюється завжди до елементарного азоту. Застосовуючи різні каталізатори (платинові, платинородієві, залізні, марганцеві і т.п.), регулюючи температуру та інші умови процесу, можна отримати в якості основного продукта реакції оксиди азоту NO або N2O. В основному використовують реакції окислення аміаку до оксиду азоту NO.
ОЦІНКА ЕМІСІЙ N2O та NOx ПРИ ВИРОБНИЦТВІ АЗОТНОЇ КИСЛОТИ
N2O
Виробництво азотної кислоти викликає емісії закису азоту N2O як побічного продукту каталітичного окислення аміаку при високих температурах.
Емісії N2O розраховують за допомогою певних коефіціентів, які основані на застосуванні конкретних технологій. Рівні емісії залежать від технології та умов виробництва.
Емісії N2O визначають за кількістю виробленої азотної кислоти. Для розрахунку емісій N2O необхідно кількість азотної кислоти в тоннах помножити на коефіціент емісії N2O на тонну азотної кислоти:
1. Для сучасних підприємств - 2 кг N2O/тонну азотної кислоти.
2. Для підприємств, які застосовують технології під атмосферним тиском - 4-5 кг N2O/тонну азотної кислоти.
3. Для підприємств, які застосовують технології з підвищеним тиском - 6-7,5 кг N2O/тонну азотної кислоти.
NOx
Азотна кислота виробляється шляхом каталітичного окислення аміаку.
Для розрахунку емісій NOx при виробництві азотної кислоти кількість азотної кислоти в тоннах необхідно помножити на коефіціент емісії, який дорівнює 0,1-1 кг NOx/тонну азотної кислоти - для виробництва концентрованої азотної кислоти або на 10-20 кг NOx/тонну азотної кислоти - для виробництва азотної кислоти під низьким тиском. Далі отримане значення емісії N2O та NOx ділять на 106 щоб перейти до гігаграмів.
ВИРОБНИЦТВО АДИПІНОВОЇ КИСЛОТИ
Адипінова кислота є дикарбоксильною кислотою. Вона виробляється з суміші циклогексанона/циклогексанола, яка окислюється азотною кислотою:
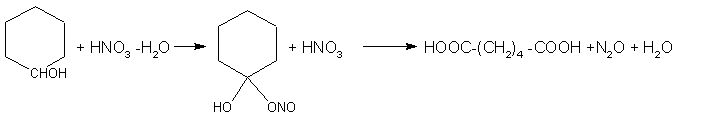
В дійсності,
крім закису азота,
утворюються також
різні окисли азоту NO,
NO2 та азот. Високий
відсоток виходу адипінової кислоти спостерігається при використанні 60-70%
азотної кислоти та температурі реакції 60-65оС.
Найважливішим синтезом на основі адипінової кислоти є конденсація її з гексаметилендіаміном при виробництві поліамідної смоли нейлон. Тому адипінову кислоту ще називають нейлоновою кислотою.
Адипінова кислота використовується також в харчовій промисловості як замінник лимонної кислоти та для виготовлення пекарних порошків.
Таким чином, виробництво адипінової кислоти приводить до емісій N2O, NOx, CO та летких неметанових органічних сполук. Оцінка емісій при виробництві адипінової кислоти залежить від методів уловлювання забруднюючих парникових газів.
ОЦІНКА ЕМІСІЙ N2O, NOx, CO ТА ЛЕТКИХ НЕМЕТАНОВИХ ОРГАНІЧНИХ СПОЛУК ПРИ ВИРОБНИЦТВІ АДИПІНОВОЇ КИСЛОТИ
Для оцінки емісій закису азоту при виробництві адипінової кислоти необхідно оціночну кількість виробленної адипінової кислоти в тоннах помножити на коефіціент емісії - 300 кг N2O на тонну виробленної адипінової кислоти.
Для оцінки емісій NOx, CO та летких неметанових вуглеводів (ЛМВ) необхідно оціночну кількість виробленної адипінової кислоти в тоннах помножити на відповідний коефіціент емісії, які наведені в таблиці 7.
Таблиця 7
Коефіціенти емісії, пов'язані з виробництвом адипінової кислоти (кг/тонну продукта)
|
NOx |
HMY |
CO |
|
8,1 |
43,3 |
34,4 |
Отриману кількість емісій в кг можна перевести в Гг, якщо отримане значення поділити на 106.
ВИРОБНИЦТВО ЧАВУНУ ТА СТАЛІ
Сировиною для виплавки чавуну є залізні руди. У процесі агломерації (збагачення руди) внаслідок реакцій відновлення і дисоціації Fe2O3 перетворюється у Fe3O4:
3 Fe2O3 + CO = 2 Fe3O4 + CO2
6 Fe2O3 = 4 Fe3O4 + O2
Відновлення заліза є основним процесом доменної плавки, оскільки у чавуні міститься 93-95% заліза; далі відокремлюють від металу пусту породу, домішки і золу палива. Оксиди заліза відновлюються вуглецем коксу, СО і частково Н2. В доменній печі залізо відновлюється з трьох форм у такому порядку:
Fe2O3 => Fe3O4 => FeO => Fe
Вуглець коксу згорає у доменній печі спочатку до СО2, а далі СО2 відновлюється вуглецем розжареного коксу до СО:
С + О2 = СО2 + 400,9 кДж
СО2 + С = 2СО - 165,8 кДж
Моноксид вуглецю є основним відновником у доменному процесі.
3Fe2O3 + CO = 2 Fe3O4 + CO2 + 63,1 кДж
Fe3O4 + CO = 3FeO + CO2 - 22,4 кДж
FeO + CO = Fe + CO2 + 13,2 кДж
FeO + C = Fe + CО - 152,6 кДж
Температура в доменній печі сягає 1800 -1900оС.
Відновлене в процесі плавки залізо частково взаємодіє з вуглецем та СО, утворюючи карбід заліза Fe3C:
3Fe + 2CO = Fe3C + CO2
3Fe + C = Fe3C
Стікаючи в горно доменної печі, залізо розчиняє в собі Fe3C, вуглець і всі інші відновлені елементи, утворюючи складний сплав - чавун.
При виробництві чавуну та сталі утворюються вуглекислий газ, оксид вуглецю(ІІ), оксиди азоту та леткі неметанові вуглеці.
ОЦІНКА ЕМІСІЙ СО2, СО, NOx та ЛЕТКИХ НЕМЕТАНОВИХ ВУГЛЕЦІВ ПРИ ВИРОБНИЦТВІ ЧАВУНУ ТА СТАЛІ
При виробництві чавуну та сталі можливі емісії СО2, СО, різних оксидів азоту та летких неметанових вуглеців. Для оцінки емісій СО2 необхідно оцінену кількість відновника, який використовується при виробництві чавуну або сталі помножити на відповідний коефіціент емісії (табл.8).
Таблиця 8
Коефіціенти емісії СО2 , пов'язані з виробництвом чавуну та сталі (тонн СО2/тонну відновника)
|
Відновник |
Коефіціент емісії |
|
Вугілля |
2,5 |
|
Кокс з вугілля |
3,1 |
|
Нафтовий кокс |
3,6 |
|
Аноди попереднього випалу та вугільні електроди |
3,6 |
Для оцінки емісій СО2 необхідно оцінену кількість відновника в тоннах помножити на коефіціент емісії СО2 (в тоннах газу на тонну відновника), наведений в табл.3.
Для оцінки емісій парникових газів непрямої дії необхідно оцінену кількість виробленого чавуну або сталі в тоннах помножити на коефіціент емісії (в г газу на тонну продукції). Відповідні значення коефіціентів емісії представлені в таблицях 9-11.
Таблиця 9
Емісії NOx , пов'язані з виробництвом чавуну та сталі (г NOx/тонну виробленого чавуну або сталі)
|
Джерело |
Коефіціент емісії (г/тонну продукції) |
|
Виробництво чавуну - випуск чавуну в чушках |
76 |
|
Виробництво сталі - прокатні стани |
40 |
Таблиця 10
Емісії СО, пов'язані з виробництвом чавуну та сталі (г СО/тонну виробленого чавуну або сталі)
|
Джерело |
Коефіціент емісії (г/тонну продукції) |
|
Виробництво чавуну - загрузка доменної печі |
1300 |
|
Виробництво чавуну - випуск чавуну в чушках |
112 |
|
Виробництво сталі - прокатні стани |
1 |
Таблиця 11
Емісії летких неметанових вуглеців (ЛНВ), пов'язані з виробництвом чавуну та сталі (г ЛНВ/тонну виробленого чавуну або сталі)
|
Джерело |
Коефіціент емісії (г/тонну продукції) |
|
Виробництво чавуну - загрузка доменної печі |
100 |
|
Виробництво чавуну - випуск чавуну в чушках |
20 |
|
Виробництво сталі - прокатні стани |
30 |
Література
1. Проблеми глобальної зміни клімату. Брошюра Ініціативи з питань зміни клімату. 2000р. 60 с.
2. Атрощенко В.А., Каргин З.А. Технологія виробництва азотної кислоти. Москва, 1980.
3. Хоруджий П.Д. Експлуатація систем водопостачання та каналізації. 1993.
4. Новицький В.З. Концепція відновлення Української хімічної промисловості, враховуючи потенціал її ресурсів// Хімічна промисловість України. 1994.№ 1.
5. Національний звіт України по питаннях навколишнього середовища. Звіт Державного комітету по статистиці України. Київ, 1991.
6. Дослідження з питань змін клімату в Україні. Розробка кадастру викидів парникових газів та аналіз заходів щодо їх пом'якшення. Аналіз заходів щодо пом'якшення впливу на зміну клімату/ Заключний звіт. - Київ, агенство з раціонального використання енергії та екології, 1996.