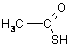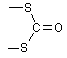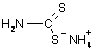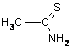ВСТУП
У даних методичних вказівках рекомендується аналіз катіонів проводити дробно-систематичним методом, використовуючи сірководневу класифікацію.
Як групові реагенти в сірководневому методі використовують карбонат амонію, сульфід амонію, соляну кислоту, сірководень та полісульфід амонію. В процесі аналізу для осадження застосовують і інші речовини – сірчану кислоту, луг, аміак, хромат-, фосфат-іони, тіосульфат натрію та ін.
Недоліками сірководневого методу є отруйність сірководню і надто довга процедура розчинення і розділення сульфідів четвертої та п’ятої аналітичних груп. Проте, якщо сульфід амонію чи сірководень застосовувати лише для відділення одних груп катіонів від інших без подальшого розчинення утворених сульфідів, тоді їх застосування буде досить обмеженим, а тривалість аналізу значно зменшиться.
Замість H2S для осадження катіонів четвертої і п’ятої груп рекомендують використовувати реагенти, що містять сірку із ступенем окислення 2- (сульфідний метод, але безсірководневий), наприклад: тіосульфат натрію Na2S2O3, тіооцтову кислоту CH3COSH, дитіокарбонат натрію Na2COS2, дитіокарбамат амонію NH2NCS2NH4, тіоацетамід CH3CSNH2 та ін. Внаслідок гідролітичного розкладу в певних умовах утворюється сірководень за схемами:
|
|
+ H2O = H2S + SO42-; |
|
|
+ H2O = H2S + CH3COOH; |
|
|
+ 2H2O + 2 H+ = 2 H2S + H2CO3; |
|
|
+ 3 H2O + 2 H+ = 2H2S + H2CO3 + 2 NH4+; |
|
|
+ 2H2O + H+ = H2S + CH3COOH + NH4+ |
Класифікація катіонів за сульфідним методом така ж, як і за сірководневим (табл. 1).
Опис ходу аналізу суміші катіонів у даному посібнику містить рекомендації до застосування в деяких випадках тіосульфату натрію замість сірководню.