+ Ba(NO3)2 =
+ 2NaNO3
До другої аналітичної групи належать катіони лужноземельних металів – Ba2+, Sr2+ та Ca2+. Груповий реагент цієї групи – карбонат амонію в нейтральному або слабколужному середовищі.
На відміну від катіонів першої групи, катіони другої групи утворюють важкорозчинні у воді карбонати.
Сульфіди катіонів другої групи добре розчинні у воді. Цим друга група відрізняється від катіонів третьої – п’ятої аналітичних груп, які утворюють малорозчинні у воді сульфіди.
Добре розчиняються у воді також нітрати, хлориди та ацетати катіонів другої групи.
Малорозчинними є сполуки з сульфатом, фосфатом, хроматом, оксалатом, фторидом та силікатом.
Катіони Ba2+, Sr2+ та Ca2+ утворюють з карбонатом амонію білі аморфні осади, які при нагріванні перетворюються на кристалічні, наприклад:
Ba2+ + (NH4)2CO3 = BaCO3 + 2 NH4+.
Осади карбонатів легко розчиняються в соляній, азотній та оцтовій кислотах, наприклад:
BaCO3 + 2 CH3COOH = Ba(CH3COO)2 + CO2 + H2O.
Варто мати на увазі, що карбонат амонію у воді розкладається з утворенням гідрокарбонату NH4HCO3 та карбамінату амонію NH2COОNH4 (амонійна сіль карбамінової кислоти NH2COOH). Оскільки для осадження катіонів другої групи потрібен саме іон CO32−, процес осадження потрібно проводити в таких умовах, коли вказані домішки перетворюються на (NH4)2CO3. Такі умови створюються, якщо реакцію проводити при нагріванні до 60оС. Тоді карбаміновокислий амоній перетворюється в карбонат за реакцією:
NH2COONH4 + H2O = (NH4)2CO3.
Крім того нагрівання сприяє перетворенню осаду карбонатів з аморфного на кристалічний. Для повноти осадження карбонатів катіонів другої групи та відокремлення їх від магнію необхідна також наявність в розчині NH4OH та NH4Cl. Розчин аміаку потрібен для перетворення гідрокарбонату в карбонат:
NH4HCO3 + NH4OH = (NH4)2CO3 + H2O.
Хлорид амонію додають для збільшення концентрації іонів амонію, що перешкоджає осадженню іонів Mg2+. Крім того, завдяки буферній суміші NH4OH + NH4Cl, в розчині підтримується рН 8-9, а це оптимальні умови для повного осадження катіонів другої групи.
2.2. Дія сірчаної кислоти та сульфату амонію.
Катіони другої групи утворюють з сульфат-іонами білі дрібнокристалічні осади BaSO4, SrSO4 та CaSO4. З них найменш розчинним є BaSO4. Він лише частково розчиняється в концентрованій сірчаній кислоті, утворюючи гідросульфат. Сульфати стронцію та кальцію помітно розчинні (особливо CaSO4) не тільки в концентрованій сірчаній кислоті, а в концентрованих HCl та HNO3 з утворенням гідросульфатів металів.
Сульфати барію, стронцію та кальцію можна перевести в розчин, нагріваючи їх з насиченим розчином карбонату амонію та розчиняючи утворені при цьому карбонати металів в оцтовій кислоті або сплавляючи сульфати з сумішшю карбонатів калію та натрію.
На відміну від сульфатів барію та стронцію, сульфат кальцію розчиняється в надлишку сульфату амонію з утворенням розчинної комплексної сполуки:
CaSO4 + (NH4)2SO4 = (NH4)2[Ca(SO4)2].
Цю реакцію використовують в аналізі для відділення Ca2+ від Ba2+ та Sr2+.
2.3. Дія лугу та гідроксиду амонію.
Розчини лугу та аміаку не осаджують катіони другої групи, тому що їх гідроксиди є досить сильними основами, причому основні властивості зростають від кальцію до барію.
2.4. Дія гіпсової води (насиченого розчину CaSO4∙2H2O).
При взаємодії солей барію з гіпсовою водою осад BaSO4 утворюється вже при кімнатній температурі; SrSO4 осаджується лише при нагріванні та (або) з часом. Таку відмінність можна пояснити тим, що через обмежену розчинність сульфату кальцію концентрація сульфат-іонів в розчині незначна, проте достатня для осадження BaSO4 (ДР = 9∙10-11), і тому цей осад випадає одразу.
Осад SrSO4 більш розчинний (ДР = 2,8∙10-7), і тому він утворюється не одразу, а при нагріванні та з часом. Реакція з гіпсовою водою рекомендується для виявлення Sr2+ після відділення Ba2+ у вигляді хромату.
2.5. Дія хромату калію (K2CrO4).
Іони Ba2+ та Sr2+ утворюють з хромат-іонами осади жовтого кольору (ДР = 1,6∙10-10 та ДР = 3,6∙10-5 відповідно). Обидва осади добре розчинні в HCl та HNO3. Проте BaCrO4 не розчиняється в оцтовій кислоті, а SrCrO4 – розчиняється.
Сполука Ca2+ з CrO42− досить добре розчинна у воді (ДР = 7,1∙10-4), тому осад може утворитися лише в розчинах з високою концентрацією Ca2+.
Іони Mg2+ з CrO42− осаду не утворюють.
Виявленню Ba2+ та Sr2+ заважають катіони, які утворюють забарвлені осади з CrO42− - Fe2+, Ag+, Hg22+, Pb2+, Bi3+ та ін.
2.6. Дія дихромату калію (K2Cr2O7).
У розчині K2Cr2O7, крім іонів Cr2O72−, містяться також іони CrO42−, які утворюються внаслідок гідролізу:
Cr2O72− + H2O = 2 CrO42− + 2 H+.
Хромат барію менш розчинний, ніж дихромат, тому додавання розчину K2Cr2O7 до розчину солі барію призводить до утворення осаду BaCrO4, а не дихромату барію:
2 BaCl2 + K2Cr2O7 + H2O = 2 BaCrO4 + 2 HCl + 2 KCl.
Осад BaCrO4 добре розчиняється в сильних кислотах (HCl, HNO3), тому в цій реакції барій переходить в осад не повністю. Для повного осадження барію до суміші слід додати розчин NaAc, який буде взаємодіяти з кислотою, що утворюється в процесі реакції, і тим самим сприяти повному осадженню барію:
CH3COONa + HCl = NaCl + CH3COOH.
В оцтовій кислоті осад BaCrO4 не розчиняється. Сумарне рівняння реакції можна записати так:
2 BaCl2 + K2Cr2O7 + H2O + 2 NaAc = 2 BaCl2 + 2 KCl + 2 NaCl + 2 HАc.
Хромати стронцію та кальцію розчинні в НАс, тому в таких умовах осадів не утворюють. Отже дихромат калію є характерним реагентом для барію, і його можна використати для виявлення барію за наявності в розчині Sr2+ та Ca2+. Цей реагент застосовується також для відділення Ba2+ від катіонів першої та другої груп.
2.7. Дія гідрофосфату натрію (Na2HPO4).
Всі катіони другої аналітичної групи взаємодіють з гідрофосфатом натрію з утворенням білих аморфних осадів кислих солей, наприклад:
BaCl2 + Na2HPO4 = BaHPO4 + 2 NaCl.
Осади гідрофосфатів добре розчинні в HCl, HNO3 та HAc.
У лужному або аміачному середовищі, де концентрація PO43− в результаті реакції
HPO42− + OH− = PO43− + H2O
зростає, в осад випадають середні солі, наприклад, Ba3(PO4)2. Такого ж складу осади утворюють Sr2+ та Ca2+. Всі осади білі, аморфні. Середні фосфати катіонів другої групи добре розчинні в сильних кислотах та оцтовій кислоті.
2.8. Дія оксалату амонію ((NH4)2C2O4).
Всі катіони другої аналітичної групи утворюють з оксалат–іонами білі дрібнокристалічні осади, наприклад:
CaCl2 + (NH4)2C2O4 = CaC2O4 + 2 NH4Cl.
Частково розчиняються в оцтовій кислоті при кип’ятінні оксалати барію та стронцію, проте CaC2O4 не розчиняється. Це одна з важливих реакцій для кальцію, але виявленню його заважають Ba2+ та Sr2+. Ці іони перед виявленням кальцію треба відділити.
Mg2+ з оксалат-іоном утворює осад лише в дуже концентрованих розчинах. Осад MgC2O4 розчиняється в солях амонію.
2.9. Дія гексаціаноферату (ІІ) калію (K4[Fe(CN)6]).
Іони Ca2+ утворюють з гексаціанофератом (ІІ) калію білий осад:
CaCl2 + K4[Fe(CN)6] = K2Ca[Fe(CN)6] + 2 KCl.
За наявності в розчині амонійних солей утворюється менш розчинний осад змінного складу, що містить іони K+, NH4+, Ca2+ та [Fe(CN)6]4−. Це одна з найхарактерніших реакцій для Ca2+.
Виявленню кальцію заважає Ba2+, який утворює аналогічний осад. Тому перш ніж виявляти кальцій, необхідно відділити барій, застосовуючи дихромат калію, як наведено вище. Стронцій не заважає виявленню кальцію з застосуванням гексаціаноферату (ІІ) калію.
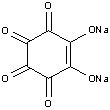
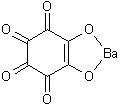
Іони Ba2+ та Sr2+ утворюють з родизонатом натрію осади бурувато-червоного та світло-буруватого кольору відповідно, наприклад:
|
|
+ Ba(NO3)2 = |
|
+ 2NaNO3 |
Відміна між ними полягає в тому, що родизонат барію в розчині HCl (2 моль/л) переходить в гідрородизонат яскраво-червоного кольору, в той час, як родизонат стронцію – розчиняється. Цю реакцію використовують для виявлення іонів барію (або стронцію за відсутності барію) в присутності кальцію та катіонів першої групи.
Леткі солі барію, стронцію та кальцію (хлориди, нітрати) забарвлюють безбарвне полум’я пальника в різні кольори: Ba2+ – в жовто-зелений, Sr2+ – в карміново-червоний, Ca2+ – в цегляно-червоний. Відповідні досліди проводять, використовуючи платинову дротинку, як це описано в дослідах по виявленню калію та натрію (1.8.).